動的光散乱 (DLS)
タンパク質・その他のバイオ医薬品の動的光散乱測定
バイオ医薬品の研究開発者向け動的光散乱装置
動的光散乱(DLS)法は、溶液中の分子や粒子によって散乱されるレーザー光強度の急激な変化を測定することで、粒子径と粒子径分布を把握する技術です。DLS分析は、ペプチド、タンパク質、ウイルス、VLPなど、多くのバイオ医薬品のサイズを素早く、ラベルフリーで、非破壊的に把握する方法です。10nmの抗体、30nmのAAV、またはサブミクロンサイズのタンパク質サンプルの平均サイズと凝集状態を読み取るには、生物製剤研究者にとって最良の選択肢です。また、回転角動的光散乱(RADLS)法は、複数の角度からデータを収集することで、DLSを基礎とするさらに強力な技術です。
Unchained Labsには、問題解決のための究極のDLS装置、StunnerとUncleがあります。StunnerとUncleは、どちらも微量のサンプルで稼働できますが、各装置にそれぞれの特長があります。濃度とサイズをすばやく測定したければStunnerを、サンプルの安定性の全体像を把握したければ、Uncleがそれぞれの目的に適したプラットフォームです。
動的光散乱法の原理
粒子の溶液にレーザー光を照射すると、多くの散乱光を検出できます。レーザーの波長が粒子よりもはるかに大きいと、どの方向にも同じ量の光が拡散します。そのため、DLS機器には660nmレーザーを使用しています。
DLSは、散乱光が時間の経過と共にどれだけ急速に変化するかを測定することで、溶液中の粒子のサイズについて多くのことを知ることができます(図1)。小さな粒子は素早く動き回るので、光の強度は素早く変化します。大きな粒子は動き回るのが遅いので、その逆です。このように、光強度の変化が速いか遅いかを分析するのがDLS分析です。
DLSの光散乱データの分析について考えてみましょう。ある時点を選択し、1マイクロ秒早送りします。ほとんどの粒子はまだ動き回っていない可能性が高いので、光散乱は変化しておらず、そのゼロ時点のデータと1マイクロ秒後のデータはほぼ同じです。つまり、高い相関関係があるのです。
次は1マイクロ秒の代わりに、1秒後のデータを確認してみましょう。ほとんどの粒子はまったく違う場所にあり、開始点と1秒後の間のデータの相関はゼロになります。この相関値をさまざまな時間の経過についてグラフにすると、相関関数が得られます(図2)。そして、相関が高い状態から相関がゼロになるまでの速さから、粒子の平均サイズがわかります。動的光散乱が光子相関分光法(PCS)と呼ばれる理由でもあります。
相関関数から、本当に得たいデータにたどり着くには、2つの分析方法がよく使われます。一つ目の方法は、相関関数に「ベストフィット」を適用し、そのフィットの形状から拡散係数、平均粒子径、粒子径分布を求めるのです。拡散係数から粒子径を求めるには、ストークスアインシュタイン方程式が便利です。
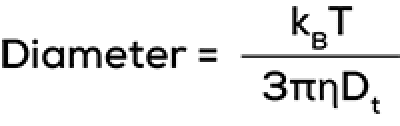
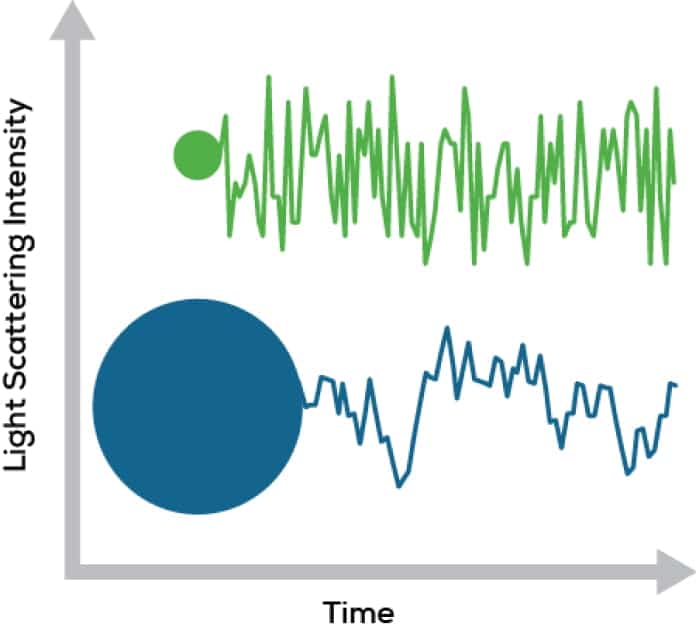
Figure 1. Light scattering intensity changes differently over time for different sized particles.
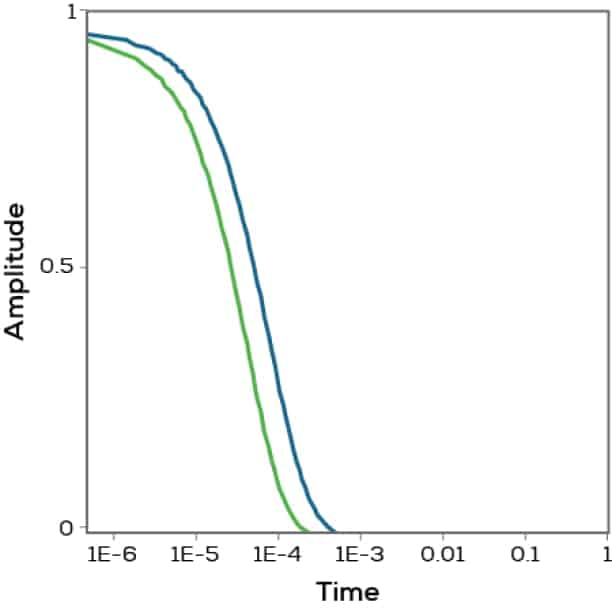
Figure 2. Correlation functions for proteins of two different sizes.
この式の他の変数を完成させるために、サンプルの温度を測定し、粘度をユーザー定義する必要があります。計算された直径は流体力学的直径です。拡散係数測定の標準偏差は粒度分布の幅に接続され、通常は多分散性指数(PDI)に変換されます。
DLS分析の2番目の方法は、DLSデータのライブラリを利用して測定データを再現し、サンプルの粒度分布を把握します(図3)。これらの分析方法はいずれも、DLSによる粒子径分析の最新のISO規格ISO 22412:2017に準拠しています。
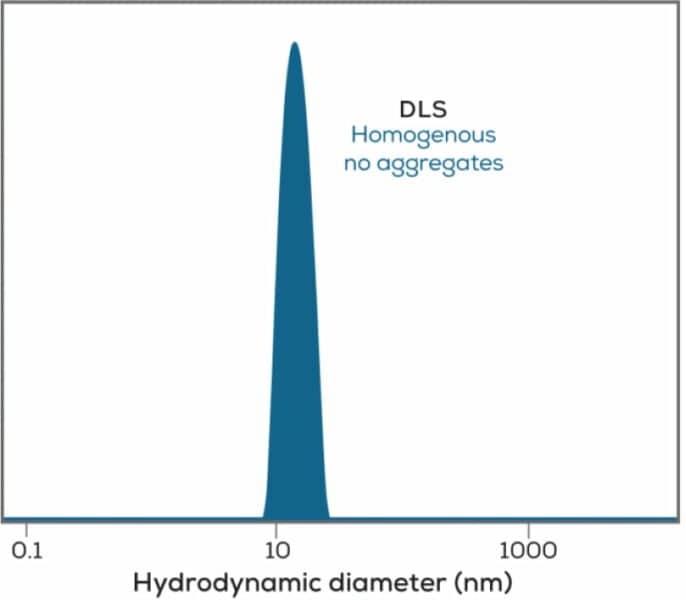
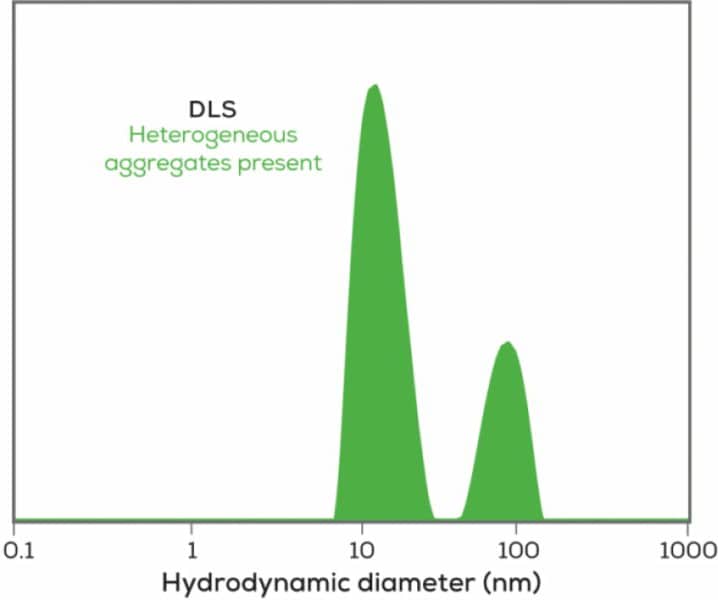
バイオ医薬品の分野では、動的光散乱はサンプルのサイズ計測できるだけでなく、サンプルが凝集しているかどうか迅速にチェックすることができます。大きな粒子は光を激しく散乱するため、DLSはサンプル中のごくまれな凝集体も検出できます。タンパク質の凝集に警鐘を鳴らすことで、すでにピークを過ぎたサンプルのデータに頼ったり、抗体がピーク時と同じように機能しなくなった理由を説明したりする必要がなくなります。
Unchained Labs 動的光散乱装置の機能:
- 1サンプルあたり1分未満で、正確で再現性のあるサイジングデータを獲得
- 微量サンプル量と低濃度という便利な組み合わせでデータを獲得
- サンプル全体の平均粒子径
- 複数のピークが検出された場合の粒度分布
- 従来のSEC分析では困難なサイズの凝集体から希少な凝集体まで、高感度で検出可能
- 0.3~1000nmのサイズ測定
- リゾチームでは0.1mg/mLまで、大きなタンパク質の場合は低濃度まで測定可能
バイオ医薬品の問題を解決するために設計された2つのソリューションがあります。以下のDLS装置をご覧ください。
Stunner
Stunnerは、UV/Visと回転角動的光散乱測定を同じサンプルから同時に行える唯一のシステムです。これらのテクニックを組み合わせることで、濃度、流体力学的サイズ、多分散性、凝集体の検出を、わずか2 µLのサンプルで一度に行うことができます。また、濃度測定は2%以内の正確性と1%以内の精度で正確に行うことができます。
また、UV/Vis分析とDLS分析を組み合わせることで、kDまたはB22データを用いてサンプルのコロイド安定性を独自に測定できます。Stunnerでは、仮定する代わりに、すべてのデータポイントで正確な濃度を読み取り、それをRADLSデータと組み合わせることで、タンパク質が溶液中でどのように相互作用しているかを示すことができます。

Frequently Asked Questions
Two Unchained Labs instruments measure light scattering. Uncle uses both static and dynamic light scattering (SLS and DLS) to get you sample stability over time or in a temperature gradient. SLS monitors aggregation (as the average molar mass of the analyte), DLS keeps an eye on the hydrodynamic size.
The second instrument that measures light scattering is Stunner - as rotational angle dynamic light scattering (RADLS): this evolution of single angle DLS is incredibly accurate and precise and keeps tabs on any aggregate present in your sample. Stunner also reports SLS at these angles and gives you the molar mass via the Raleigh ratio.
In order to measure dynamic light scattering, you look at light scattered over a time interval. The molecules and particles in solution are excited by a laser which causes them to scatter light. As the analytes constantly move around (due to Brownian motion), the light scattered in a certain direction interferes constructively or destructively and the net intensity fluctuates over time – the larger the analyte, the slower the fluctuation.
By analyzing the fluctuation through autocorrelation analysis, we can determine the translational diffusion coefficient of the particle which can then be converted to hydrodynamic size using the Stokes-Einstein equation.
A second datapoint from a DLS experiment is the polydispersity of the sample, this is a measure of its homogeneity and a metric of the spread of sizes present within the sample.
In a DLS experiment the fluctuation of light scattered at a discrete angle over time is measured by a photon counting module. A correlator coverts fluctuations over time to information about translational diffusion properties which can, with knowledge of temperature of measurement and viscosity of solution, be converted to hydrodynamic size.
Depending on the type of analysis, a DLS experiment results in the z-average size and polydispersity or a distribution of sizes and their polydispersity.
Both dynamic light scattering (DLS) and small angle X-ray scattering (SAXS) measure scattering of electromagnetic radiation by an analyte. The incident beam excites electrons in the analyte and they emit the scattered light upon return to ground state.
The X-rays in a SAXS measurement are more energetic and this experiment can yield size and information on the internal structure of the analyte.
As DLS uses visible light to yield information about size and homogeneity, it requires a laser as the source of excitation and not an X-ray source.
Static light scattering (SLS) measures the total intensity of light scattered at a certain angle. This intensity, with knowledge of concentration and refractive index of the analyte, can be used to determine molar masses. Monitoring SLS over time or a temperature gradient lets you spot aggregation as it occurs.
Dynamic light scattering (DLS) measures the fluctuations of light scattering intensity over time. This gives access to the translational diffusion of the analyte, which can be converted to hydrodynamic size and polydispersity.
Though similar in name, SLS and DLS measure different properties of analytes and are orthogonal techniques.
より詳しく知りたい場合はこちら
動的光散乱装置を使えばバイオ医薬品の課題を分析することができます。何かご不明な点がございましたらお気軽にお問い合わせください。



